摘要
宫腔镜手术以其对子宫腔病变定位诊断和精准治疗等优势,被誉为经自然腔道微创手术的“典范”;其在保留子宫、去除病变组织同时,恢复子宫腔形态与功能,实现子宫腔整复手术治疗目的。近年来,随着临床应用的普及开展、手术器械的研发完善、诊疗方法的推陈创新以及围手术期管理的细化规范,使宫腔镜子宫腔整复手术得到了长足发展。2012年“妇科宫腔镜诊治规范”距今已经十余年,为了更好适应当今临床诊疗与发展需求,中华医学会妇产科学分会妇科内镜学组结合国内外最新循证医学证据和我国宫腔镜子宫腔整复手术临床实践,对宫腔镜手术指征、施术前准备、新设备器械的进展、操作要点、术中与术后监护以及手术并发症防治等方面进行了全面更新完善,旨在规范宫腔镜子宫腔整复手术临床应用,提高诊疗效果,造福广大病患。
宫腔镜是经阴道自然腔道对子宫腔及子宫颈管各类病变进行诊断与微创整复手术的治疗方法,以其直观观察、定位准确、保留器官与保护功能等优势,被誉为子宫腔疾病治疗的“典范”;宫腔镜手术是与开腹手术、经阴道手术和腹腔镜手术并列的妇科手术基本技能。2012 年,中华医学会妇产科学分会妇科内镜学组制定发表的“妇科宫腔镜诊治规范”至今已时隔十余年,十余年来,随着宫腔镜子宫腔整复手术临床应用的普及开展、手术器械的研发改良、手术种类的创新拓展以及对围手术期管理的深入细化,使宫腔镜在子宫腔整复手术中的应用得到了进一步发展和完善。结合国内临床应用现状及大量临床研究,对2012年“妇科宫腔镜诊治规范”进行更新完善,以便更好规范宫腔镜子宫腔整复手术的临床应用,提高诊疗效果,惠及广大病患。本指南修订基于近十年国内外相关的循证医学证据结果,参考国际指南并结合我国实际情况,经过多次讨论和修改而制定。指南制定遵循指南研究与评价工具(Appraisal of Guidelines Research and Evaluation, AGREEⅡ)原则。循证医学等级采用美国预防服务工作组分类系统进行分级。证据等级:Ⅰ级:从至少 1个合理设计的随机对照试验中获得的证据。Ⅱ级:从精心设计的队列研究或病例对照分析研究中获得的证据,该研究最好来自1个以上的中心或研究小组;或在干预或不干预下,从多个时间序列获得的证据。在不受干预的试验中产生的重要结果也可以被视为这类证据;或从未随机化的精心设计的对照试验中获得的证据。Ⅲ级:基于临床经验、描述性研究或专家委员会报告的权威人士的意见。推荐等级:A 级:基于良好和一致的科学证据,高度确信利明显大于弊;B级:基于有限的或不一致的科学证据,高度确信获益较多或至少中度以上获益较多;C级:基于专家共识,至少中度确信能够有一定的获益[1,2]。
一
宫腔镜诊断与手术的适应证与禁忌证
1. 诊断适应证
(1)各类子宫腔病变所致异常子宫出血的评估;
(2)评估不孕症的子宫、子宫颈因素;
(3)子宫内膜损伤所致宫腔粘连的形态学评估;
(4)子宫及下生殖道畸形的分类评估;
(5)子宫腔异物及宫内节育器异常的定位评估;
(6)各类子宫腔影像学异常的病因评估;
(7)子宫内膜癌早期诊断、保留生育功能治疗及随访的评估[3];
(8)各类子宫腔手术后的二次探查评估;
(9)各类子宫颈及子宫颈管病变的协助诊断;
(10)顽固性阴道排液的病因检查;
(11)幼女阴道异物及占位病变的病因检查。
2. 手术适应证
(1)子宫内膜息肉引起各类临床症状;
(2)子宫肌瘤影响子宫腔形态并引起相应的临床症状;
(3)子宫内膜损伤所致宫腔粘连,患者有迫切的生育愿望,或由于粘连导致经血流出受阻;
(4)子宫及下生殖道畸形影响生育或生理功能;
(5)子宫腔异物,包括宫内节育器取出、既往子宫手术残留缝线取出、残留妊娠组织取出等;
(6)特殊部位妊娠,如妊娠囊位于子宫颈、宫角、剖宫产术后子宫瘢痕部位及子宫肌壁等;
(7)剖宫产术后子宫瘢痕憩室(又称剖宫产术后子宫切口缺损)影响生育或生理功能;
(8)子宫内膜不典型增生及早期子宫内膜样癌保留生育功能治疗;
(9)局灶或囊性子宫腺肌病病灶切除;
(10)各类子宫颈管赘生性病变切除;
(11)幼女阴道异物、阴道或子宫颈肿瘤活检。
3. 禁忌证
(1)绝对禁忌证:严重内、外科合并症不能耐受手术操作。
(2)相对禁忌证:①盆腔炎症及阴道炎症急性期、或体温>37.5 ℃;②子宫活跃性大量出血、重度贫血;③正常妊娠状态;④3个月内有子宫穿孔史;⑤浸润性子宫颈癌;⑥生殖道结核未经抗结核治疗;⑦子宫腔深度超过12cm。
二
宫腔镜施术前准备与注意事项
1. 检查项目:宫腔镜施术前需行必要的检查以排除手术禁忌证,包括血常规、阴道分泌物、心电图、传染病系列(乙型肝炎、艾滋病、梅毒等)等,根据病情需要酌情进行盆腔超声等影像学检查。
2. 子宫颈预处理:非妊娠状态的子宫颈管狭窄坚韧、难以扩张,尤其是有子宫颈手术史或绝经期的患者。约一半的宫腔镜手术并发症与困难的子宫颈扩张相关[4]。对于上述子宫颈坚韧、难以扩张的患者进行子宫颈预处理是保障宫腔镜手术成功的关键。子宫颈预处理的方法包括药物预处理、机械预处理及激素类预处理,多中心前瞻性研究证明,前列腺素PGF2α衍生物类如卡前列甲酯栓1 mg,对于子宫颈坚硬患者具有良好的软化效果,可以阴道或直肠给药,简单方便[5, 6](Ⅰ级证据,A级推荐);前列腺素PGE1衍生物米索前列醇也被认为具有子宫颈软化作用,是子宫腔手术中可供选择的子宫颈预处理药物之一。上述药物在使用时应注意如青光眼、哮喘、过敏体质等用药禁忌证[4,7]。机械预处理目前以简易子宫颈扩张棒为主,子宫颈坚硬时有插入失败的风险。雌激素类制剂预处理主要针对绝经期患者,建议在宫腔镜手术前半个月开始用药。证据表明,局部使用普罗雌烯阴道胶丸具有软化子宫颈及阴道组织的作用,局部剂型不通过血液屏障,不影响子宫内膜厚度等[8]。药物预处理对子宫颈扩张困难、置镜疼痛的未生育以及绝经期患者能够有效软化子宫颈组织,显著提高患者满意度[9]。子宫颈预处理的具体方法详见中华医学会妇产科学分会妇科内镜学组2020年发布的《宫腔镜手术子宫颈预处理临床实践指南》[10]。
3. 子宫肌瘤预处理:对于影响子宫腔形态、体积较大、合并严重贫血的患者提倡酌情使用促性腺激素释放激素激动剂(GnRH-a)进行术前预处理[11]。GnRH-a可通过降低类固醇激素水平、直接抑制肌瘤的细胞增殖、促进肌瘤细胞凋亡、减少瘤体血供等多种机制缩小肌瘤体积,用药3个月,肌瘤体积缩小20%~50%[12]。对体积较大的黏膜下肌瘤不仅增加了手术的可行性,同时保障了手术的安全性。随机对照试验证明,0型~Ⅰ型黏膜下肌瘤接受GnRH-a预处理后手术时间明显缩短、灌流介质吸收量显著降低[11]。并且,对于合并严重贫血的患者,应用GnRH-a纠正贫血后对于保证手术疗效和手术安全也是至关重要的[13](A级推荐)。
4. 膨宫与灌流介质:膨宫与灌流是实施宫腔镜子宫腔整复手术的必备条件。一般情况下,膨宫压力设置为80~100 mmHg(1 mmHg=0.133 kPa)或≤患者平均动脉压;施术操作前应排空灌流介质连通管道内残存的空气。
灌流介质的选择依据手术中使用的电能与非电能系统决定。灌流介质的种类分为非电解质介质(如5%葡萄糖、5%甘露醇等)、电解质介质(主要为生理盐水)。目前,国内使用单极电能手术系统时,灌流介质主要为5%葡萄糖(糖尿病患者可用5%甘露醇);使用双极电手术系统时,灌流介质常选择生理盐水。需要注意,尽管电解质介质由于含有电解质离子,引起稀释性低钠血症的概率较非电解质介质低[14],但是,电解质介质过量吸收依然存在体液超负荷及心肺功能衰竭的风险。因此,无论使用电解质还是非电解质灌流介质,手术中均应监测介质的使用量和进入患者体循环的吸收量[15](Ⅰ级证据,A级推荐)。
三
宫腔镜手术设备器械进展
近年来,随着光能、电能不同能源形式的研发转化以及对传统手术器械的改良完善,使子宫腔整复手术中可供选择的器械呈现多样化,在一定程度上方便和促进了临床应用,简要介绍如下。
1. 窄带光成像系统(narrow-band imaging,NBI):是将氙光源产生的光波进行过滤,筛选波长415 nm±30 nm的蓝光和波长540 nm±30 nm的绿光,增强对黏膜血管网络纹理观察的可视度[16]。在宫腔镜手术中,主要用于对子宫内膜病变和增生性病变及癌变组织血管分布密集部位的观察,对微小病灶组织进行聚焦定位并实施靶向活检及切除治疗[17]。系统评价表明,与普通光成像相比,NBI可明显提高对子宫内膜癌及子宫内膜不典型增生诊断的敏感度[17, 18](Ⅰ级证据);对子宫内膜病变识别的特异度能较普通光成像提高14.9%,在高危内膜增生的识别方面,其敏感度提高了20%[18]。尽管如此,由于NBI光波对组织的穿透深度仅有0.15~0.30 nm[19, 20],因而不能对肥厚内膜及较大病灶深处血管的观察,同时,即使是对子宫内膜表层血管特征的识别,也与施术者的经验和施术技巧有关。
2. 宫腔镜组织旋切系统:目前,高频电能系统仍然是宫腔镜手术的主要能源形式。在此基础上研发的组织旋切系统如Myosure、IBS和Truclear等,其作用原理均是在电能做功的基础上,利用机械旋切实现对病灶组织的切除,粉碎的组织碎屑随灌流介质排出,保持了子宫腔视野的清晰,同时旋切系统粉碎组织时不需要反复进出子宫腔,相对缩短了手术时间,不仅操作简单易学,也在一定程度上降低了灌流介质过量吸收-体液超负荷综合征的风险[21]。目前组织旋切系统主要应用于已排除恶变的子宫内膜息肉、0型~Ⅰ型黏膜下肌瘤、残留妊娠组织切除等[14]。使用组织旋切系统需要注意的问题:(1)由于旋切刀头是通过转动粉碎组织,无法电凝止血;(2)粉碎的组织标本细碎影响组织病理学检查,可能存在遗漏癌变组织的风险[22];(3)旋切刀头与镜体同轴并且隐藏在镜体外鞘之内,无法实现对埋入内膜下方或肌壁内占位病灶的切割,例如对Ⅱ型肌瘤的切除尚缺乏有效的证据支持[14]。
3. 激光:激光是较早应用于宫腔镜手术治疗的能源形式之一。临床中使用的激光包括气体激光、掺钕钇铝石榴石(Nd:YAG)激光、半导体激光等[23]。半导体激光是近年来国外研究较多并在临床实际中应用的宫腔镜手术激光,其以980 nm和1 470 nm的双波长模式,对病灶组织进行切割的同时产生凝固效应达到止血的效果[24],其组织效应能够与传统高频电手术相当。在宫腔镜手术中通过半导体激光进行子宫纵隔切开术和子宫内膜息肉切除术是安全有效的,同时也有成功实施黏膜下肌瘤切除术的报道[25]。使用激光作为能源时:(1)需要配备激光设备和激光保护装备;(2)难以获得供组织病理学检查的标本,同样也存在遗漏癌变组织的风险;(3)费用相比高频电手术昂贵等。
4. 超细宫腔镜:超细宫腔镜是在传统诊断型宫腔镜镜体外鞘直径4.5~5.5 mm的基础上,对宫腔镜外鞘进行改良,使外鞘直径缩小、镜体更加纤细,目前临床用于诊断的超细宫腔检查镜外鞘直径2.7~3.1 mm;附带操作孔道的宫腔检查镜外鞘直径3.8 mm,内含1.7 mm操作孔道,可在诊断的同时用于组织活检、异物取出等[14]。超细手术宫腔电切镜的外鞘直径由传统的8.5~9.0 mm(26~27 Fr.)缩小为5.3 mm(16 Fr.),可在无麻醉状态下实施子宫内膜息肉及子宫颈息肉切除手术[26]。超细宫腔镜的优势是在非麻醉状态下更易通过子宫颈管,降低患者在施术操作时的疼痛感。但是,由于:(1)无麻醉、在意识清醒状态下施术,患者对疼痛的耐受性可能更低;(2)镜体过细致成像不佳、视野不清;(3)微型器械对病灶处理的作用有限,单次手术失败及再次手术的风险增加[27];因此,在选择使用超细宫腔镜手术时应充分评估手术的可行性。
5. 冷器械:是通过非能量介入方式对组织进行钳夹、分离或剪切等机械操作,尽管使用冷器械无电能源系统介入,但是,由于受机械能做功原理和纤细操作孔道的限制,微型冷器械使用时对病灶组织的钳夹、牵拉及剪切等操作明显受限;对于子宫肌瘤和宫内节育器残留等坚硬组织的钳夹和牵拉,需要通过配置有3~4 mm操作孔道的传统宫腔镜实施手术。与能源系统介导的手术宫腔镜相比,冷器械使用时需要熟悉其工作原理,对于不能完成的手术操作需要及时更换电能手术系统,除此以外,选择冷器械还应客观评估适宜的手术指征、手术操作的可行性,并结合施术者的经验等进行综合评估。
四
宫腔镜检查临床应用
1. 检查时机的选择:对于月经周期规律的患者,实施宫腔镜检查的最佳时机是月经干净后3~7 d(早卵泡期),此时子宫内膜较薄,子宫腔视野相对开阔,便于观察;对于月经周期紊乱的患者,可以安排在任何时候进行检查,但需注意检查前应排除妊娠的可能;对于异常子宫出血的患者,可在出血期间进行检查,明确出血原因并为后续治疗提供依据。需要说明的是,对于急性大量出血的患者是否应立即行宫腔镜检查尚存争议,需要结合患者全身情况及出血原因综合分析,酌情选择[28](C级推荐)。
2. 传统宫腔镜检查:传统宫腔镜检查对子宫腔形态和病变进行直观观察,已成为子宫腔疾病诊断的经典方法。目前,临床用于诊断的硬管型宫腔镜外鞘直径4.5~5.5 mm,带有操作孔道的硬管型宫腔镜外鞘直径6.0~6.5 mm,镜体前视角0~30°,可对子宫腔的全貌进行直观观察与定位活检,明确病变性质并为进一步精准切除病灶、手术治疗奠定基础。
3. 阴道内镜检查:阴道内镜检查又称非接触式宫腔镜检查,是指在宫腔镜检查过程中不放置阴道窥具、无须子宫颈钳夹持及扩张子宫颈、也不需要在麻醉状态下完成检查操作。系统评价(纳入6项随机对照试验)表明,阴道内镜与传统宫腔镜检查的检查效果无显著差异,但阴道内镜手术时间更短,患者疼痛显著减轻[14]。国内的随机对照试验(n=400)证明,阴道内镜检查较传统宫腔镜检查,检查时间、患者疼痛程度均有显著降低,并且阴道内镜检查在术后并发症方面同样显著低于传统宫腔镜检查[29](Ⅰ级证据)。
阴道内镜技术应用中需要注意的问题:(1)镜下寻找、辨别子宫颈外口和进入子宫颈内口尚有一定的技术门槛,施术者经验不足或子宫颈内外口粘连狭窄均有可能导致镜体置入失败;(2)阴道内镜是否增加术后感染也是值得关注的问题,尽管目前尚无相关证据表明阴道内镜技术可能导致术后感染风险的增加,但是仍需强调操作前彻底的阴道消毒以及尽量避免镜体与阴道壁的接触[30]。有鉴于此,目前仍需进行高质量研究以更好地评估阴道内镜技术(大小、角度、刚性/柔性)应用于不同类型子宫腔病变诊断的可行性和优势。
4. 门诊或日间宫腔镜治疗:是在门诊进行宫腔镜检查的同时对子宫腔病变部位进行活检或简单的治疗操作,由于是在门诊检查的同时完成治疗,故统称为门诊或日间宫腔镜治疗。
近年来,临床为简化手术流程、缩短患者等待住院时间而开展的门诊或日间宫腔镜治疗主要以子宫内膜息肉切除、0型黏膜下肌瘤切除、子宫纵隔切开、宫腔粘连分离、宫腔内残留妊娠组织切除等简单的手术操作为主[31]。与住院实施的宫腔镜手术操作相比,门诊宫腔镜手术在临床应用中存在的问题日渐显现,多中心、随机对照、非劣效性研究(n=507)表明,门诊宫腔镜子宫内膜息肉切除的手术失败率高于住院宫腔镜手术,患者对门诊宫腔镜手术的耐受度低于住院宫腔镜手术,门诊宫腔镜手术后仍需再次手术治疗的概率高于住院宫腔镜手术,这与门诊宫腔镜手术使用的微型器械、非能源操作的局限、意识清醒状态下患者的耐受性下降等因素有关[27](Ⅰ级证据)。除此以外,由于子宫特殊的解剖学特点和对施术者较高的操作经验要求,也增加了门诊宫腔镜手术的困难。大样本量回顾性研究(n=31 052)表明,门诊宫腔镜手术失败最常见的原因中疼痛占32.7%、子宫颈狭窄占44.3%、子宫腔视线不佳占4.3%,门诊宫腔镜手术在绝经后人群中置镜失败的概率也明显高于生育年龄妇女[32](Ⅱ级证据)。
基于现有证据,大规模开展门诊或日间宫腔镜手术应综合考虑影响手术操作的风险因素,对于绝经、子宫颈狭窄、合并严重的全身基础性疾病需要严密进行监测或者对不能在局部麻醉下耐受手术操作的患者、复杂的子宫腔病变,均不建议选择门诊或日间宫腔镜手术。对于符合手术要求的患者,施术前还应充分交代手术失败的可能性、由于疼痛无法耐受手术、病灶切除不全需要二次手术以及严重手术并发症需要转入住院手术室或开腹探查的可能性等[14,27]。此外,鉴于目前在门诊或日间实施的宫腔镜黏膜下肌瘤切除、子宫纵隔切开及宫腔粘连分离等研究多为单中心小样本量研究[31],仍需大样本量、前瞻性、高质量临床研究证据进一步评价。
总之,开展门诊或日间宫腔镜手术应进行详细的病史收集、影像学评估以及对子宫腔病变程度的综合评价预估,最大限度降低手术失败的风险。与此同时,门诊或日间宫腔镜手术必须在具备充分抢救设备及抢救条件的门诊手术室进行、拥有完善的抢救流程、配备专业经验丰富的施术医师和麻醉医师,以保障患者安全为前提[14](C级推荐)。
五
宫腔镜子宫腔整复手术指征与要点
1. 子宫内膜息肉切除术(hysteroscopic polypectomy):是对有症状的子宫内膜息肉诊断与治疗的微创方法。目前,对于有症状的子宫内膜息肉推荐使用宫腔镜从根蒂部完整切除息肉进行组织病理学检查,避免盲视下刮宫术;对绝经后子宫内膜息肉,特别是体积较大或合并子宫出血的患者,不推荐期待观察[33, 34](A级推荐)。对于无症状的子宫内膜息肉如果存在恶变风险因素如息肉直径>2 cm、绝经期、伴有代谢综合征、应用他莫昔芬药物等,均建议行息肉切除术[35, 36](B级推荐)。对于合并子宫内膜息肉的不孕症患者,息肉切除术后自然妊娠率和辅助生殖治疗成功率均显著增加[37](Ⅰ级证据)。
手术要点与共识:(1)对于有生育要求的子宫内膜息肉患者,手术中应避免损伤基底层子宫内膜;(2)对于绝经期及具有恶变风险的子宫内膜息肉患者,手术时应尽可能切除息肉基底部组织,必要时应对息肉周边内膜进行活检。
2. 子宫肌瘤切除术(hysteroscopic myomectomy):宫腔镜子宫肌瘤切除术的主要手术指征:(1)0型黏膜下肌瘤;(2)Ⅰ型、Ⅱ型黏膜下肌瘤;(3)部分影响子宫腔形态的Ⅲ型肌瘤。
手术要点与共识:(1)建议施术前宫腔镜联合B超检查,通过STEPW[大小(size)、宫腔部位(topography)、基底宽度占宫壁范围(extension of the base)、肌瘤位于肌层的占比(penetration into the myometrium)、侧壁位置(lateral wall position)]分类系统评估手术的复杂程度、肌瘤完全切除的可能性、手术时间以及发生体液超负荷的风险[38](Ⅰ级证据,A级推荐)。(2)对于合并严重贫血的患者应进行预处理纠正贫血后再施术。(3)对于肌瘤直径>4 cm的Ⅱ型黏膜下肌瘤及肌壁间内凸肌瘤应酌情进行施术前GnRH-a预处理,缩小肌瘤体积,减少肌瘤血供,提高手术安全性。(4)对于有生育要求的肌瘤患者建议使用针状电极在肌瘤突出表面开窗,通过水压分离使瘤体向子宫腔暴露,便于直视下进行切除或钳夹取出;对于开窗后不能突向子宫腔的肌瘤部分不宜强行向肌壁内深挖,将肌瘤切除至与周围肌壁平齐,肌壁间残留的肌瘤视术后情况酌情二次手术。(5)对于有生育要求的多发肌瘤患者,术后3个月酌情宫腔镜二次探查评估子宫腔形态并进行相应的备孕指导等处理。
3. 子宫纵隔矫治术(hysteroscopic mytroplasty):通过宫腔镜切开和(或)切除纵隔组织,恢复子宫腔解剖学形态。手术指征:(1)由于子宫纵隔引起的复发性流产;(2)合并不孕症的子宫纵隔排除其他不孕因素,证据表明,宫腔镜子宫纵隔矫治术能够改善生育结局[39](Ⅱ级证据),提高活产率;因此对于有不良孕产史或排除其他因素的不孕症患者,建议酌情手术治疗(B级推荐)。
手术要点与共识:(1)子宫纵隔是子宫发育畸形所致的子宫形态学异常,宫腔镜联合腹腔镜是诊断与鉴别诊断的“金标准”方法[40]。(2)宫腔镜联合腹腔镜在手术中不仅能够精准诊断分类、及时发现子宫穿孔和进行及时补救处理,同时,对于合并不孕症的患者还能够明确盆腹腔内其他影响生育的因素并进行同期处理。(3)B超监护简便、无创伤,但不能直视盆腹腔病灶,不能同时进行子宫穿孔及盆腔共存病灶的处理[41]。(4)无论何种监护方法均应以患者安全作为首选考虑因素,选择何种监护方式应根据患者的具体情况酌情决定。(5)宫腔镜纵隔切开或切除至子宫底部时,应注意辨别纵隔组织与子宫肌层组织的分界,避免损伤正常子宫肌壁组织。有限的病例报告报道了子宫纵隔切开或切除术后发生妊娠子宫破裂的病例,考虑与手术损伤子宫肌层组织、术中发生子宫不全穿孔或完全穿孔等因素有关。纵隔切开或切除矫治术后创面愈合需2~3个月的时间,术后3个月酌情宫腔镜二次探查确定子宫腔形态并指导患者备孕[42]。
4. 宫腔镜宫腔粘连分离术(hysteroscopic adhesiolysis):是对由于子宫内膜损伤所致子宫腔形态学破坏实施的子宫腔整复手术。通过宫腔镜直视观察子宫腔形态、内膜损伤程度以及残留子宫内膜分布,是施术前进行评估的首选方法[23,43](A级推荐),也是制定个体化手术方案的依据。手术目的:恢复子宫腔解剖学形态及子宫腔容积,治疗相关症状(不孕、疼痛等),预防再粘连形成,促进子宫内膜再生修复,恢复患者生育功能[23,43]。手术指征:(1)有强烈生育愿望的、子宫内膜损伤致宫腔粘连的不孕、月经过少患者;(2)子宫内膜损伤致子宫颈管或宫腔粘连造成的积血、疼痛、闭经及不孕等相关临床症状[44]。
手术要点与共识:(1)宫腔粘连分离子宫腔整复手术,是恢复子宫腔解剖学形态的首选治疗方法[23,43]。(2)施术前应进行宫腔镜检查,全面评估子宫腔形态、明确粘连范围与性质、残留内膜多少与分布,制定个体化手术方案与术后综合管理措施[45]。(3)手术中应贯彻切除瘢痕组织、保护残留内膜、恢复子宫腔形态的施术原则[23,43]。(4)手术中酌情选择B超或腹腔镜监护,能够有效减少子宫穿孔并发症的发生[41];腹腔镜监护可以及时发现并处理子宫穿孔,对盆腹腔存在的疾病和影响生育的因素进行处理。(5)预防手术后再粘连是提高手术疗效的重要措施,子宫腔适形支撑球囊通过屏障效应阻隔创面之间的相互贴附,能够降低宫腔粘连分离子宫腔整复手术后再粘连的形成[46, 47](A级推荐)。(6)除了经典的雌孕激素人工周期促进子宫内膜再生修复,目前尚无在临床广为使用的促进子宫内膜再生修复的措施,干细胞、细胞因子及富血小板血浆(PRP)等是近年来尝试使用的促进子宫内膜再生修复的方法,有限的临床证据表明,其对促进子宫内膜再生修复的作用是可行的,但需要多中心、大样本量研究进一步验证、完善[48]。
5. 剖宫产术后子宫瘢痕憩室切开术(hysteroscopic repair of cesarean scar diverticulum):是对剖宫产术后子宫切口愈合缺陷通过宫腔镜治疗的手术方法[49]。手术指征:(1)由于子宫下段愈合缺陷所致异常子宫出血、经药物治疗无效、无再生育要求的患者;(2)经影像学精准测量子宫切口缺陷底部距子宫浆膜面的子宫肌层厚度≥3 mm。
手术要点与共识:(1)施术前应进行影像学与宫腔镜的全面评估,通过MRI精准测量憩室顶端具有足够厚度的肌层组织;(2)手术中应切除足够的憩室下方组织,充分引流憩室内潴留的经血,同时,电凝憩室腔炎性内膜组织及增生的血管;(3)建议手术酌情在超声监护下进行[50](C级推荐)。
6. 剖宫产术后子宫瘢痕妊娠切除术(hysteroscopic resection of cesarean scar pregnancy):剖宫产术后子宫瘢痕妊娠(CSP)是剖宫产术后远期并发症之一,也是一种特殊类型的异位妊娠,明确诊断后推荐酌情终止妊娠。通过宫腔镜或宫腔镜联合其他方法对CSP进行分型诊断和手术治疗是安全可行的[51],参照2016年中华医学会《剖宫产术后子宫瘢痕妊娠诊治专家共识》中对CSP的分型标准[52],通过宫腔镜手术处理CSP应酌情联合B超或腹腔镜,手术指征包括:(1)Ⅰ型、Ⅱ型CSP;(2)部分未破裂的Ⅲ型CSP。
手术要点与共识:(1)施术前应进行全面的影像学评估,必要时应选择MRI精准测量妊娠囊与膀胱之间子宫肌层的厚度,明确妊娠组织的范围、血供分布、是否植入肌层等;(2)对Ⅰ型和部分Ⅱ型CSP,宫腔镜联合B超进行妊娠组织切除是安全可行的[53];(3)对于血供丰富、妊娠囊与膀胱之间子宫肌层菲薄或中断、妊娠组织体积较大的Ⅱ型和Ⅲ型CSP,需要进行充分的施术前准备,通过药物治疗、子宫动脉栓塞或子宫血管阻断等措施进行预处理后再酌情施术;(4)对于需要进行子宫瘢痕部位切除修补的CSP建议联合腹腔镜手术,待宫腔镜切除妊娠组织后,腹腔镜进行子宫瘢痕部位切除修补手术[54, 55]。
7. 子宫腔异物取出术(hysteroscopic removal of foreign body):是在宫腔镜直视下定位取出残留、嵌顿于宫腔内的异物或妊娠组织。手术指征:(1)宫内节育器残留,包括宫内节育器断裂、部分嵌顿入子宫肌层或被粘连组织包裹等;(2)妊娠组织残留;(3)既往子宫手术缝线暴露。
手术要点与共识:(1)宫腔镜取出宫内节育器需根据嵌顿入子宫肌层的程度酌情选择超声或腹腔镜监护;(2)应避免对血流丰富或存在动静脉瘘的妊娠组织即刻实施宫腔镜手术,建议酌情使用药物杀胚或中医药活血化瘀进行预处理后、待血hCG趋于正常、残留妊娠组织缩小以及周围血供不丰富时再酌情处理。
六
术中与术后监护
宫腔镜子宫腔整复手术特殊的施术环境有别于传统的开放性手术、腹腔镜手术和经阴道手术,由于涉及到膨宫压力与灌流介质,由此可能引起的灌流介质过量吸收-体液超负荷综合征、气体栓塞以及心肺功能衰竭等致命性手术并发症,严密的术中与术后监护是保障手术安全的必要措施。
1. 生命体征监护:包括呼吸、脉搏、血压、血氧饱和度及心电监护等。
2. 灌流介质监测:依据手术中使用的灌流介质种类进行精确计算及管理使用。主要监测指标为灌流介质负荷量(=施术中使用的灌流介质总量-灌流介质流出量)。负欠量是指进入患者体循环的介质量,短时间内灌流介质过快吸收可能在患者体循环特别是末梢循环积聚致使体液超负荷,引发肺水肿与急性左心功能衰竭,对于非电解质介质还有可能引致稀释性低钠血症并由此导致各类临床症状。使用的灌流介质种类不同,发生体液超负荷时的负欠量预警值不同,原则上,当使用非电解质介质时,负欠量一般以1 000 ml为界,而对于电解质介质,负欠量一般以2 500 ml为界,超过该数值时应积极采取相关的预防措施、严密监测心肺功能并争取在短时间内结束手术[14]。虽然电解质介质过量吸收所致电解质紊乱的风险相比较非电解质介质低,但是,短时间大量电解质介质进入体循环同样有可能发生体液超负荷的风险,特别是对于患有心血管疾病、肾功能不全以及年长的患者,手术中应由多学科团队(MDT)参与并严密监护灌流介质的负欠量。美国妇产科医师协会和欧洲妇科内镜学会提倡对于疑难复杂的宫腔镜子宫腔整复手术应使用灌流介质自动监测系统,持续动态测量灌流介质的出入量及宫腔内压力,当介质负荷量差值达到预设阈值时即自动停止灌流并报警,以此降低灌流介质过量吸收-体液超负荷综合征的发生率[14]。
3. 腹腔镜与B超监护:两者均为宫腔镜子宫腔整复手术常用的监护方法,如何选择需要根据手术的种类、施术者对手术风险的评估以及患者的具体情况决定,具体选择参考上文各类手术方式中的专家观点。
4. 术后监护:(1)迟发性电解质紊乱-稀释性低钠血症,手术后除了生命体征监测以外,最重要的是由于灌流介质过量吸收引起的体液超负荷综合征。对手术中灌流介质用量较多特别是使用非电解质介质时,术后应酌情检测血电解质离子,并以此为依据,选择静脉补液种类并纠正电解质紊乱。(2)酌情使用抗生素:对于有感染高危因素的患者建议酌情选择抗生素预防感染发生。
七
手术并发症预防与处理
1. 子宫穿孔:子宫穿孔是宫腔镜子宫腔整复手术的常见并发症,发生率文献报道不一。子宫穿孔的风险因素包括:(1)子宫颈狭窄及子宫颈扩张困难,约50%的穿孔与此有关;(2)对子宫肌壁切割或破坏过深,特别是子宫腔压力过高时,子宫肌壁厚度变薄;(3)子宫腔形态改变如较大的黏膜下肌瘤、宫腔粘连及子宫畸形等[56]。
处理:(1)立即停止手术,明确穿孔部位,并检查是否存在邻近器官损伤并进行相应处理;(2)对于穿孔范围小、无活动性出血和器官损伤者,可给予收缩子宫、止血药物等对症处理;如不能奏效,应酌情放置子宫腔适形球囊压迫止血;(3)对于穿孔合并盆腹腔器官损伤、大出血等,应及时腹腔镜或开腹手术探查,修补损伤的器官并进行相应处理。
预防:(1)施术前应评估子宫颈状态,对于既往有子宫颈手术史、绝经期、无阴道分娩史以及子宫颈发育不良等特殊人群,应积极进行子宫颈预处理;(2)避免暴力扩宫;(3)对于穿孔高风险的手术如子宫肌瘤、子宫内膜损伤所致宫腔粘连、子宫畸形等的手术,建议酌情联合B超监护或腹腔镜监护,避免对子宫肌层破坏过深,及时发现和避免子宫穿孔发生[57, 58, 59]。
2. 大出血:出血量超过500 ml被视为手术严重并发症之一[60, 61],术中或术后大出血的原因:(1)子宫肌层破坏过深,如子宫穿孔、Ⅱ型或Ⅲ型黏膜下肌瘤切除、严重宫腔粘连或子宫畸形矫治手术等;(2)子宫颈撕裂,与子宫颈预处理不全、暴力扩宫有关;(3)妊娠相关疾病的子宫腔手术,如合并动静脉瘘的胎盘植入、子宫颈妊娠、CSP等[62];(4)凝血功能障碍性疾病,如凝血因子缺乏、严重肾功能衰竭透析患者等。
处理:(1)子宫腔适形球囊压迫是针对手术中或手术后急性大出血的有效止血措施[63];(2)酌情选择收缩子宫平滑肌的药物,如前列腺素衍生物类药物[6]、缩宫素、垂体后叶素等;(3)上述方法不能奏效时酌情选择子宫动脉栓塞或子宫切除术[14]。
预防:对于高危出血风险的手术应充分进行施术前评估,针对具体风险因素制定应对预案,如针对子宫肌瘤应酌情进行预处理,针对子宫颈坚硬的患者提倡子宫颈预处理,对妊娠相关疾病的手术也应充分术前评估、制定预防术中大出血的预案后再实施手术。
3. 灌流介质过量吸收-体液超负荷综合征:是宫腔镜子宫腔整复手术特有的严重并发症之一,诱发原因可能与下列因素有关:(1)膨宫压力设置过高[64, 65];(2)手术时间过长;(3)子宫腔创面过大,如子宫内膜损伤致重度宫腔粘连、Ⅱ型及肌壁间肌瘤等手术,对子宫肌壁破坏过深、血窦广泛开放,致使灌流介质大量、快速进入患者体循环。主要临床表现以急性左心功能衰竭、肺水肿等循环障碍为主的一系列症状体征,诊断治疗不及时还可能出现脑水肿、抽搐、心肺功能衰竭甚至死亡。
处理:(1)一经确诊应立即停止手术,动态监测血流动力学变化。(2)吸氧、利尿、纠正心肺功能、警惕肺水肿、脑水肿的发生。(3)纠正电解质紊乱,发生稀释性低钠血症时,计算补钠量,依据下列公式:所需补钠量=(正常血钠值-测得血钠值)×52%×体重(kg)[66]。将计算所得补钠量换算为3%或5% NaCl溶液,开始的补钠量按照计算总量的1/3补给,动态监测尿量及血清电解质变化,酌情增减;切忌快速、高浓度补钠,以免造成暂时性脑内低渗透压状态,使脑组织间的液体转移到血管内,致使脑组织脱水,引发大脑损伤的风险[67]。(4)以生理盐水作为灌流介质时,虽然发生低钠血症的风险降低,但介质吸收过量仍有体液超负荷的风险[65],此时,频繁使用利尿剂虽有助于改善体液超负荷,但有可能促发低钠血症,此时,需要启动MDT协作诊疗或重症监护病房(ICU)进行全面的体液平衡管理。
预防:(1)严密监护手术中灌流介质出、入量与负欠量,适时给予利尿剂,静脉补液以含电解质离子的介质为主;(2)避免对子宫肌壁切割过深,对较大或合并贫血的Ⅱ型黏膜下肌瘤或肌壁间肌瘤施术前应进行预处理;(3)避免过高的子宫腔压力,一般情况下子宫腔压力设置≤100 mmHg或≤患者平均动脉压[67];(4)控制手术时间;(5)对于年长患者特别是合并心血管疾病、肾功能衰竭等合并症时,更应严密监测体循环阻力指数(SVRI)、电解质及血浆渗透压;(6)酌情建立灌流介质动态监测控制体系,手术团队应及时报告灌流介质使用量,达到预设阈值时应启动报警提示。
4. 气体栓塞:气体栓塞是罕见但严重的并发症,致死率高达69.2%[66]。诱发因素:(1)手术中宫腔镜反复进出子宫腔,空气经过子宫腔创面开放的血管进入静脉循环;(2)灌流介质管道内的气体排出不全或进入空气;(3)子宫腔压力设置过高等。气体栓塞发病突然,进展快,早期症状包括呼气末CO2分压(PCO2)下降、心动过缓、血氧分压(PO2)下降,心前区闻及大水轮音等;继之血流阻力增加、心输出量减少,患者出现紫绀、低血压、呼吸急促、心肺功能衰竭而死亡。
处理:气体栓塞一旦发生应立即停止操作,组织MDT进行抢救治疗。(1)将患者置于左侧卧位及头低臀高位,可促进空气或气体向右心室尖部漂移,减少右心室流出道梗阻[65];(2)正压吸氧,纠正心肺功能衰竭;(3)输入生理盐水促进血液循环,放置中心静脉导管,监测心肺动脉压[62]。
预防:(1)施术中应避免头低臀高体位[67];(2)施术前排空灌流介质连通管道内的气体;(3)进行子宫颈预处理,避免粗暴扩宫致子宫颈裂伤;(4)避免设置过高的子宫腔压力;(5)尽量减少手术过程中器械反复进出子宫腔形成“虹吸”效应致使空气进入子宫腔[62];(6)重视气体栓塞的早期临床表现与识别,加强术中监护与急救处理。
宫腔镜子宫腔整复手术严重并发症的抢救流程见图1。
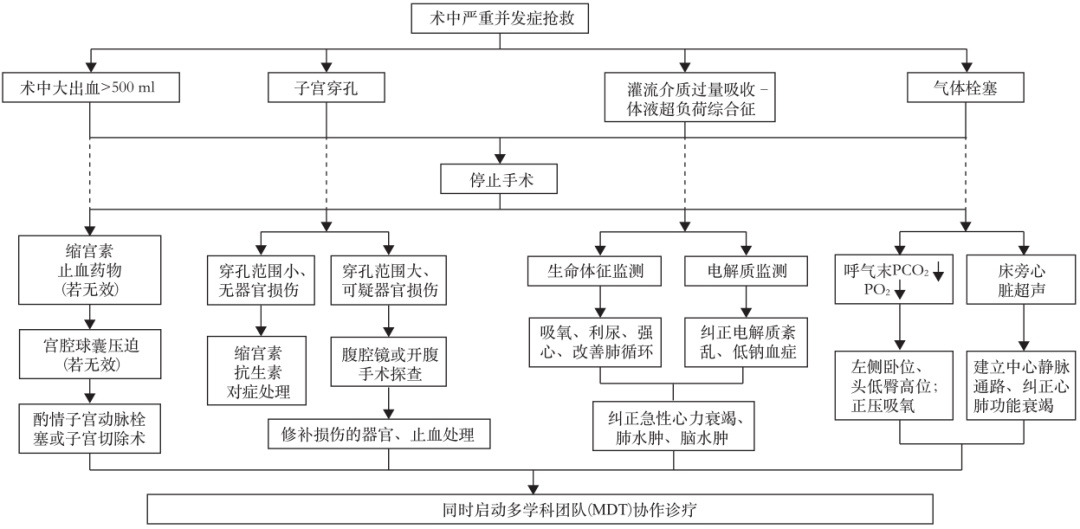
图1 宫腔镜子宫腔整复手术严重并发症抢救流程图
5. 感染:目前尚无高质量的证据证明预防性使用抗生素能有效防止盆腔感染的发生。但如果宫腔镜检查或手术后发生感染致盆腔脓肿时则临床后果严重。因此,施术前需严格掌握手术适应证,生殖系统感染急性期禁忌手术;对于有感染高危因素的患者建议使用抗生素预防感染[68]。
需要强调的是,宫腔镜子宫腔整复手术是保留子宫和保护生育功能的手术,施术前应充分评估手术的可行性、安全性与治疗效果;治疗失败或症状复发可酌情选择后续治疗,包括二次宫腔镜手术、药物治疗或子宫切除手术;因此,施术前需要重视与患者的告知及知情同意,切忌违反患者意愿强制施术。
顾问:郎景和(中国医学科学院北京协和医院)、夏恩兰(首都医科大学附属复兴医院)
执笔专家:段华(首都医科大学附属北京妇产医院)、张颖(首都医科大学附属北京妇产医院)、郭银树(首都医科大学附属北京妇产医院)
秘书:李博涵(首都医科大学附属北京妇产医院)
参加讨论专家(按照姓氏汉语拼音顺序排列):白文佩(首都医科大学附属北京世纪坛医院)、蔡云朗(东南大学附属中大医院)、陈红(武汉大学中南医院)、池余刚(重庆市妇幼保健院)、狄文(上海交通大学医学院附属仁济医院)、段华(首都医科大学附属北京妇产医院)、冯云(云南省第一人民医院)、高婷(中国科学技术大学附属第一医院 安徽省立医院)、郭银树(首都医科大学附属北京妇产医院)、郝敏(山西医科大学第二医院)、花茂芳(连云港市第三人民医院)、金力(中国医学科学院北京协和医院)、李立安(解放军总医院第一医学中心)、李小毛(中山大学附属第三医院)、林凤(温州医科大学附属第一医院)、林元(福建省妇幼保健院)、凌斌(中日友好医院)、刘木彪(珠海市人民医院)、卢美松(哈尔滨医科大学附属第一医院)、罗喜平(广东省妇幼保健院)、马德美(山东大学第二医院)、孟跃进(郑州大学第二附属医院)、牛菊敏(沈阳市妇婴医院)、彭超(北京大学第一医院)、邱剑萍(南京医科大学附属苏州医院)、任琛琛(郑州大学第三附属医院)、荣风年(山东第一医科大学第一附属医院)、石彬(河北医科大学第二医院)、隋龙(复旦大学附属妇产科医院)、孙静(上海市第一妇婴保健院)、谭欣(四川大学华西第二医院)、王敏(中国医科大学附属盛京医院)、王素敏(南京医科大附属妇产医院)、王武亮(郑州大学第二附属医院)、王晓辉(江西省景德镇市第二医院)、王晓雷(山东省威海市妇幼保健院)、王晓黎(海南省妇女儿童医学中心)、王沂峰(南方医科大学珠江医院)、谢晓英(赣南医学院第一附属医院)、徐大宝(中南大学湘雅三医院)、许泓(中国福利会国际和平妇幼保健院)、薛翔(西安交通大学第二附属医院)、杨雯(解放军总医院第一医学中心)、杨欣(北京大学人民医院)、姚书忠(中山大学附属第一医院)、叶海燕(广东省人民医院)、易萍(重庆医科大学附属第三医院)、应小燕(南京医科大学第二附属医院)、袁瑞(重庆医科大学附属第一医院)、张峰(山东省临沂市妇幼保健院)、张松英(浙江大学医学院附属邵逸夫医院)、张晓玲(江西省妇幼保健院)、张信美(浙江大学医学院附属妇产科医院)、张颖(首都医科大学附属北京妇产医院)
利益冲突 所有作者声明无利益冲突
参考文献:略
本文编辑:沈平虎

 搜索医生
搜索医生

